SGLT2阻害薬使用時のinitial dipはほっておいてもいいの?
腎不全が進行したり、糖尿病の初期には糸球体の内圧が上がり過剰濾過という状態になります。
この状態になると糸球体に負担がかかり腎障害が進行していきます。
この過剰濾過を改善するのにSGLT2阻害薬やACE-I、ARB等を使用するのですが、開始初期にには一過性のeGFR低下を経験します。

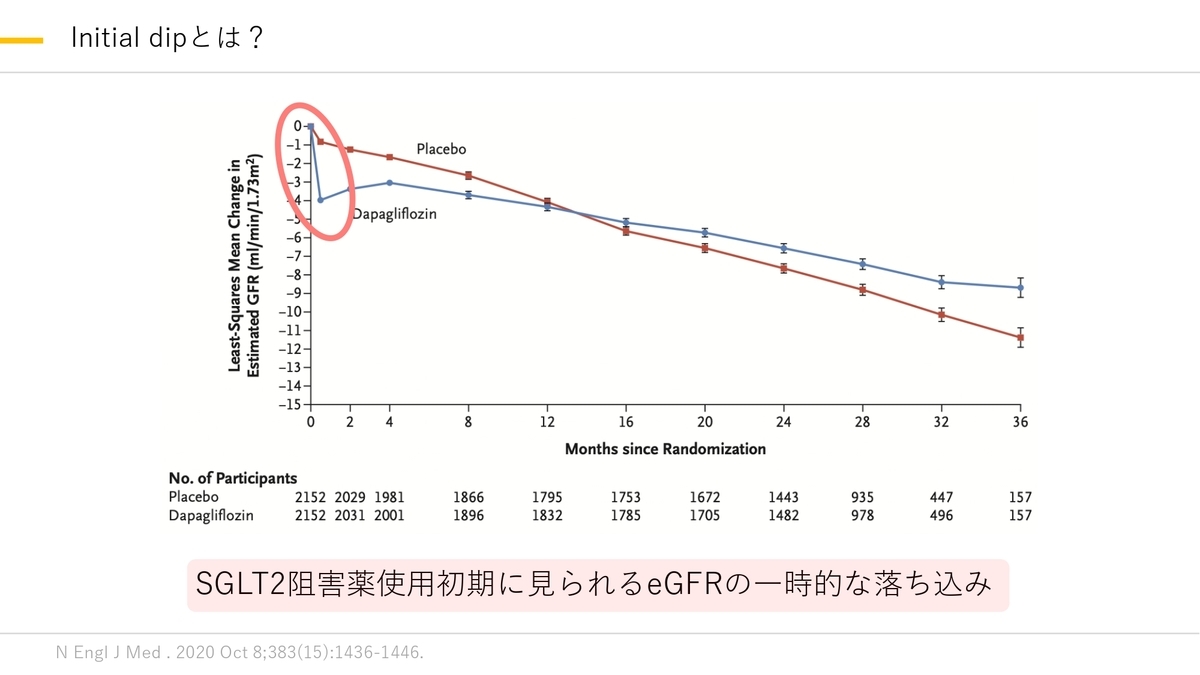
このinitial dipは糸球体内圧が下がったことによる一時的なものと考えられていましたが本当にこのSGLT2阻害薬によるeGFRの落ち込みが腎予後に悪影響を与えないかどうかはわかっていませんでした。
ACE阻害薬、ARBでももちろん糸球体内圧の低下からinitial dipは起こりますがこちらについては起こってもその後腎機能の低下が緩やかになることがわかっています。
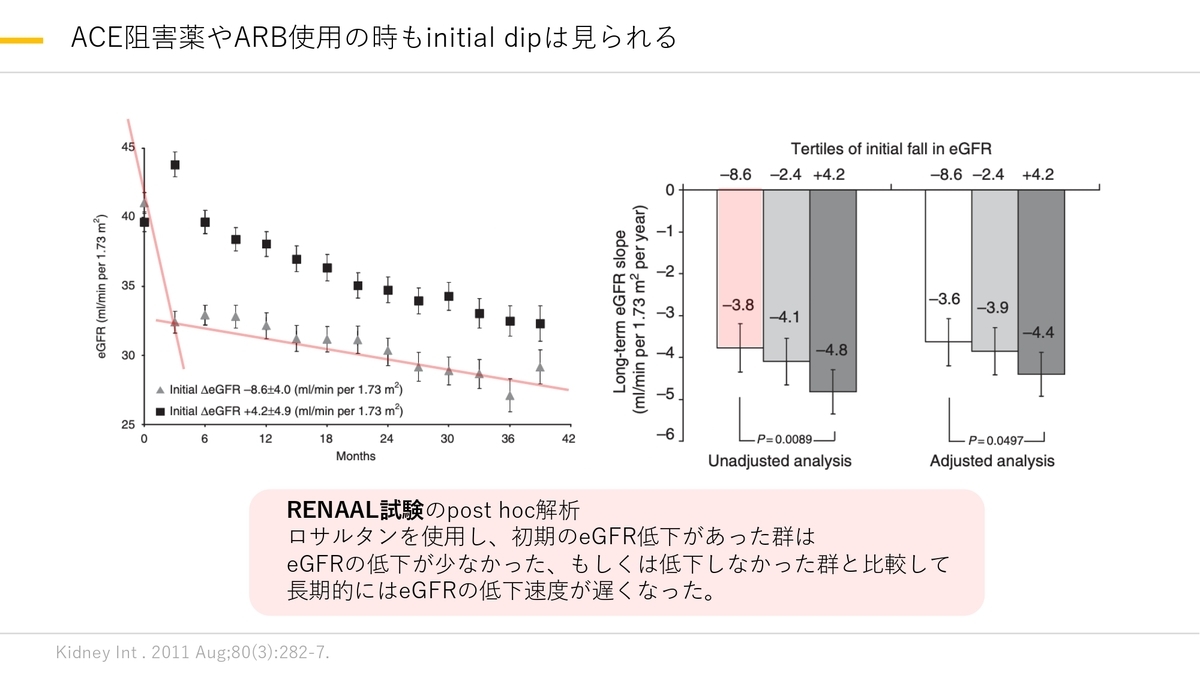
ただ30%以上eGFRが低下した方は減量、もしくは中止を検討する必要があります。

患者さんによってはeGFRが低下すると内服を辞めてしまう方がおられます。
僕は「過剰濾過は残業も土日出勤もさせてブラック企業のような働き方をさせている状態で、こんな会社は長く続きません。糸球体を定時で帰らせてあげて、休日も休ませてあげる働き改革をしてあげているんです。最初は業績は落ちますが、長い目で見ると長持ちする会社になるんですよ。」と説明しています(笑)

と入っても本当に大丈夫なのかどうか?という疑問に対する一つの答えを示してくれる論文を読んでみました。
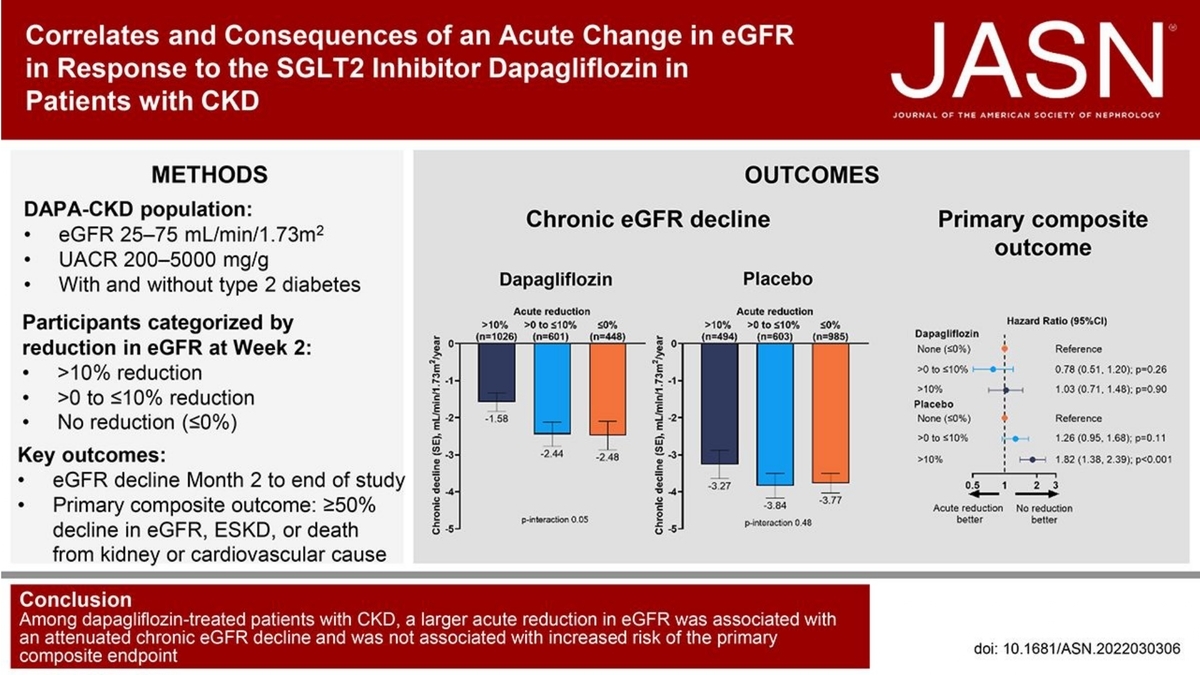




このデータを見ているとinitial dipが起こった群ではeGFRの低下速度がACE-I、ARBと同様にゆっくりになると言う結果。
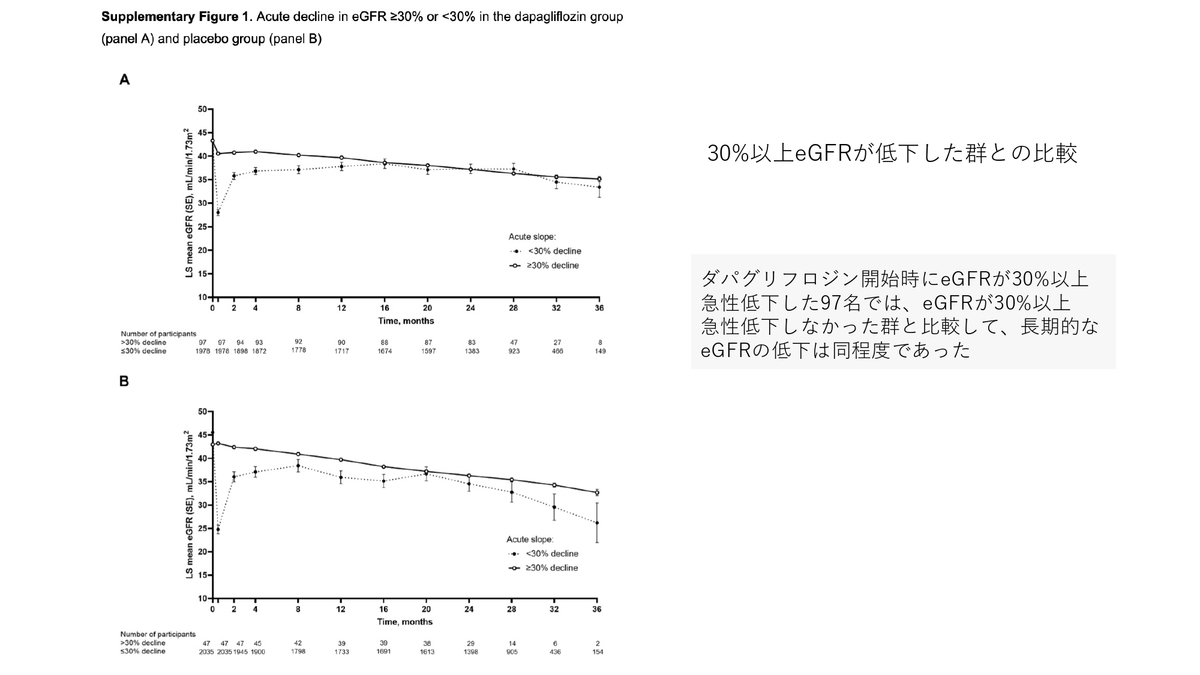
30%どちらも以上eGFRが低下した群としなかった群の比較もされており、長期的なeGFRの低下は同程度ということでした。
ただ、Limitationにもあげられていましたが30%以上低下した人数が少なかったので、きちんとした評価をするには検出力不足と思われます。
この結果で30%以上eGFRが下がっても大丈夫というのは注意が必要です。
とはいえ、やはりinitial dipはある程度起こっても大丈夫そうなので安心しました。
適応を間違えなければsGLT2阻害薬はやはりいい薬だと思います。
適応はまだまだ難しいところもありますが、それはまた別の機会に。。。
腎生検を使用した予後予測の有用性
Biopsy-proven CKD etiology and outcomes: Chronic Kidney Disease Japan Cohort (CKD-JAC) study
Nephrology Dialysis Transplantation, gfac134, https://doi.org/10.1093/ndt/gfac134
腎生検を使用した予後予測の有用性についての論文です。
やはり原疾患を意識することは大事ですね。
後輩達にも、「病名のところをCKDとだけ記載してるけど、その原疾患まで意識することが専門医としては必要だよ」とよく言うんですが、これだけ生命予後や腎予後が違うのであればやはり慢性腎不全と同一に扱わずにそれぞれの原疾患で考えていく事が必要です。
個人的には腎生検で腎硬化症や糖尿病性腎症等が合併していることがあると思いますがその場合はどのカテゴリーに入れたのか気になりました。おそらく腎炎があればそちらのカテゴリーに入れてるんだと思いますが。
でも大事な研究ですね。
















造影剤使用と6ヶ月後における腎機能の影響
院内抄読会で読むためにまとめてみました。
アウトカムをAKIではなく、6ヶ月後の腎機能としていることと、検証の仕方が面白い論文だなぁと思います。
最近色々な分野で造影剤は腎機能に影響を与えないので気にしなくていいんだよーという講演や発表を見ることがありますが、自分としてはまだ手放しに影響が全く無いとは言いづらいと思っています。
ただ、以前考えていたほどの影響は無いだろうなという感じです。
せめて時間があるなら他のAKIを起こす可能性があるような内服薬を中止したり脱水を改善してから撮りましょう、でも緊急事態など必要ならば腎機能を気にする必要は無いので撮ってください!というスタンスです。





















特発性好酸球増多症(IHES)の腎病変を有する患者における臨床的、および病理学的特徴
気づいたらほったらかしにしていたこのblog。アウトプットが大事だと気を入れ替えて続けて行こうと思います。
近医から発熱、腎機能障害で紹介になった患者さん、腎機能障害だけではなく、掻痒感・落屑を伴う皮膚病変や肺の浸潤影なども見られたため入院加療に。
ただ、新規薬剤もあるので入院時からすべてストップし精査を行っていました。
結局好酸球増多症は改善せず、マルクやBAL、腎生検の結果特発性好酸球増多症と診断が付きました。
腎生検の結果は間質性腎炎は見られており好酸球も少し浸潤していますが、血中の好酸球も5000/μLを超えており、そら浸潤も多少あるだろうと。。。
腎障害の原因が果たして好酸球増多症によるものなのかどうか気になったので読んでみました。
Dong JH, Xu ST, Xu F, Zhou YC, Li Z, Li SJ. Clinical and morphologic spectrum of renal involvement in idiopathic hypereosinophilic syndrome. Clin Exp Nephrol. 2021 Mar;25(3):270-278. doi: 10.1007/s10157-020-02012-5. Epub 2021 Jan 4. PMID: 33398597.


免疫チェックポイント阻害薬によるAKIのリスクファクターと生命予後
最近免疫チェックポイント阻害薬が周囲で使用される機会が増えてきました。
腎臓内科が主体で使うことは殆どないため、あまり声がかかることは少ないのですが、以前免疫チェックポイント阻害薬を使用して血球貪食症候群、急性腎不全を起こした時はかなり大変なことになりました。その時参考にした論文がこちらです。
Hemophagocytic lymphohistiocytosis with immunotherapy: brief review and case report
やっぱり慣れてない薬の副作用が出た時には焦ります。
今回CENにこのような論文が載っていたので読んでみました。
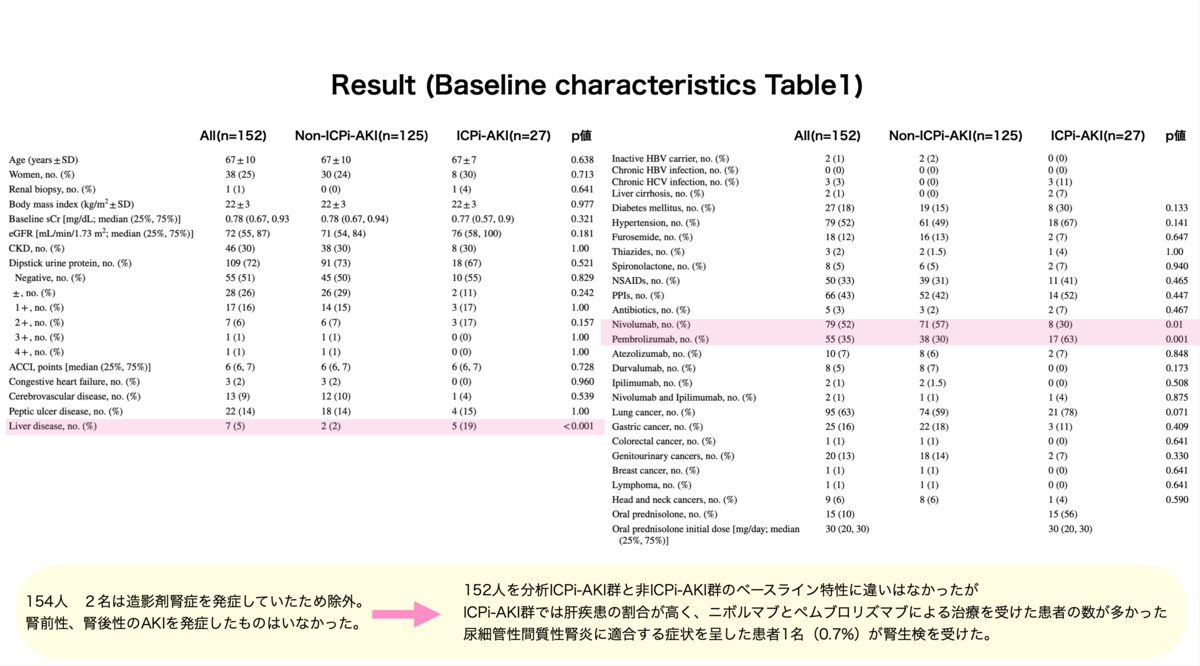
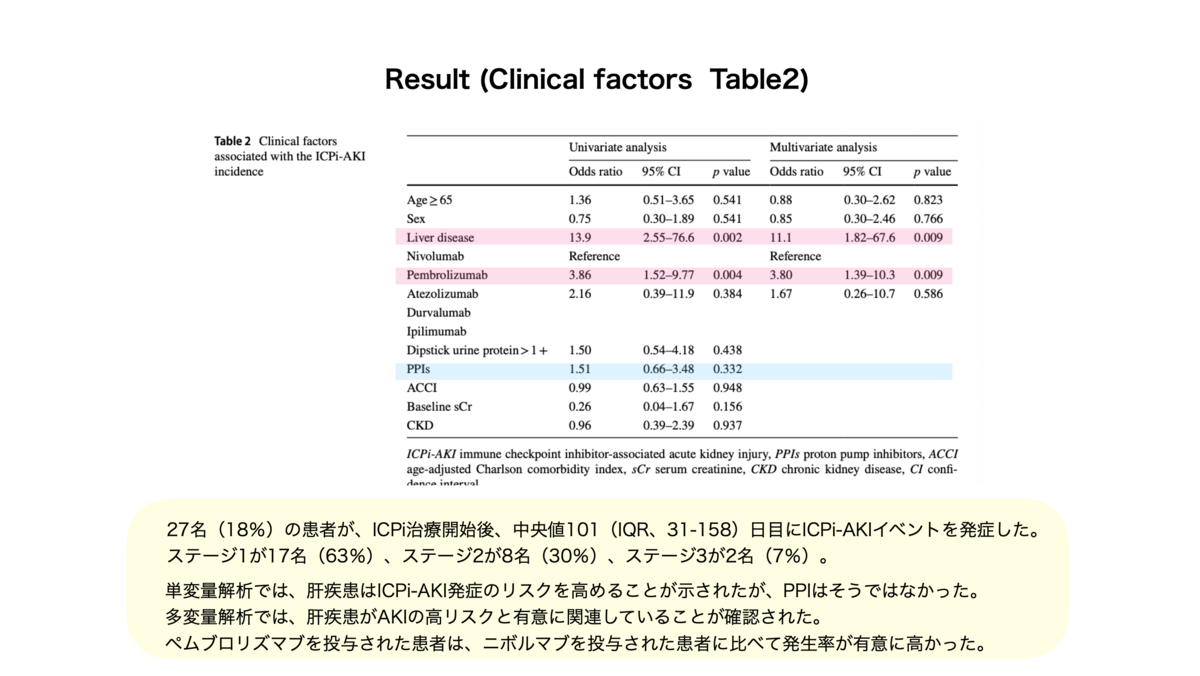
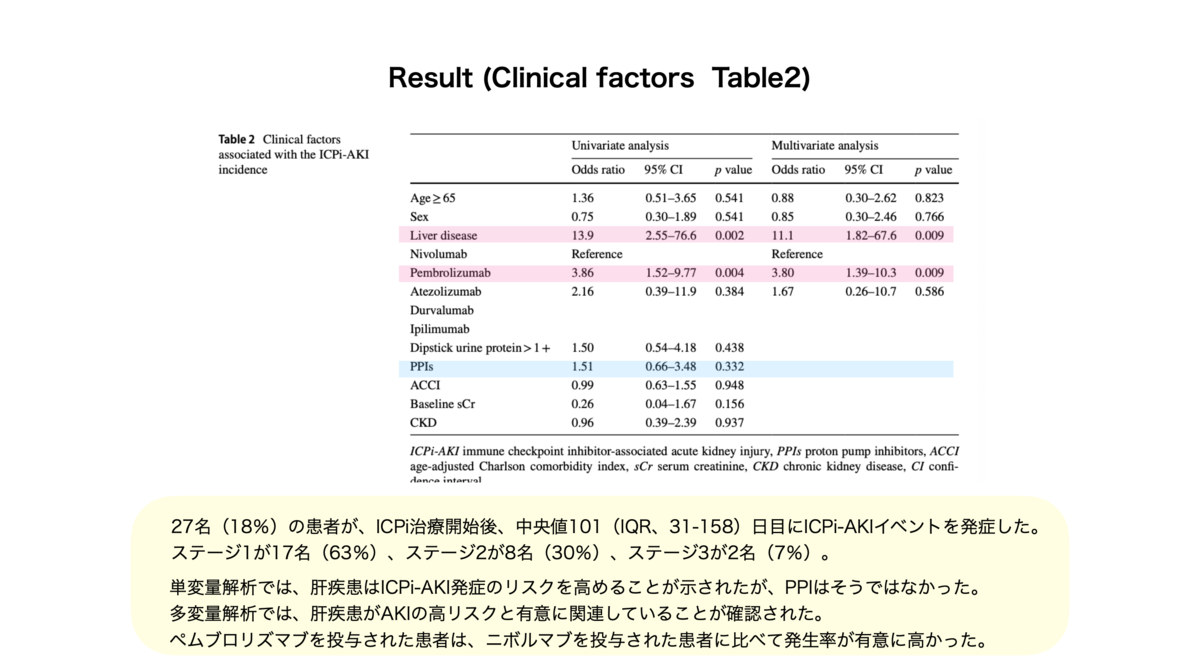
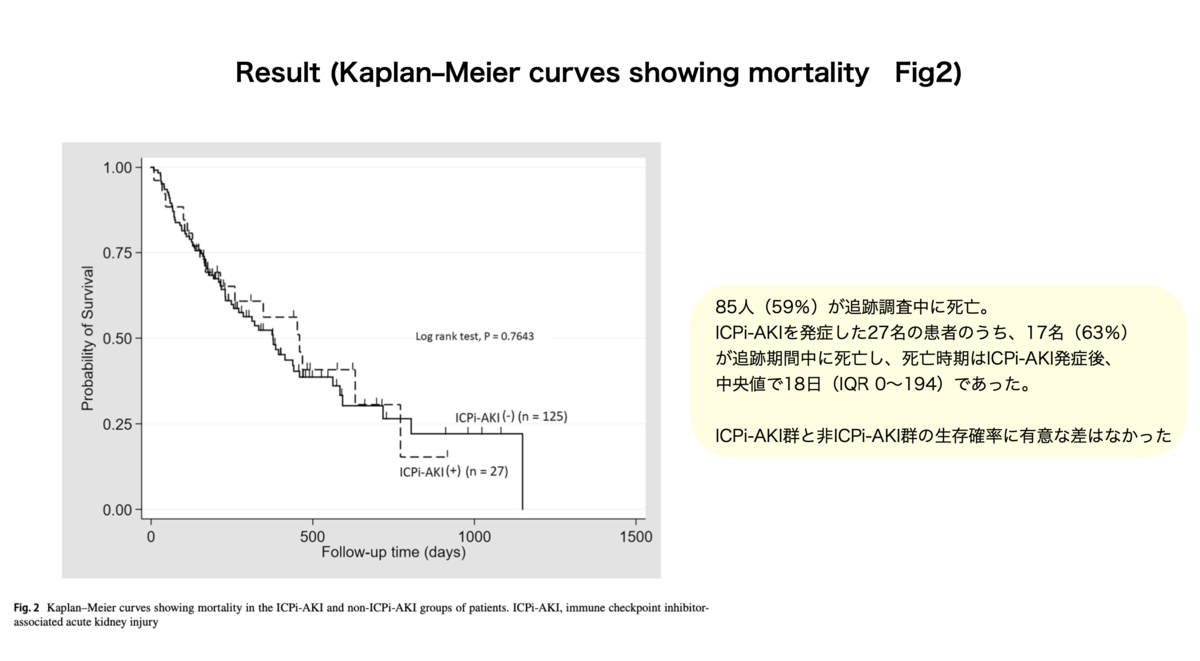 ○この研究で得られた重要な知見
○この研究で得られた重要な知見・ICPi-AKIは死亡率に影響を与えない
原発性鎖骨下静脈血栓症 (Paget-Schroetter syndrome)
シャントを作る事による心機能への影響はどうか?
いつも透析導入の時に長期留置型カフ付きカテーテルにするかシャントを作るか、心機能を見て考えることが多いです。
明確な指標は無く、心不全を繰り返している方、重度の弁膜症がある方、拡張能障害がある方などはシャントを作るのに注意が必要だと思いながら年齢やADLを見て決定しています。
良い論文は無いかと探してみたのですがなかなか難しい。。
シャントを作る→心機能や生命予後がどうなるかという研究ではなく、シャントを閉じる→心機能がどう改善するかという研究で調べたかったものと少し方向は違いますが読んでみました。
https://www.ahajournals.org/doi/full/10.1161/CIRCULATIONAHA.118.038505
この論文は腎移植後にシャントを閉鎖した患者とそうでない患者の左室心筋重量や心機能を見たRCTです。シャント閉鎖群の方が左室心筋重量の低下、proBNP低下が見られたというものでした。
この結果からシャント作成による心機能低下や生命予後がどうかという事は議論する事はできませんが、やはり一定の影響はあるんでしょうね。まぁ当然といえば当然ですが。
シャント作成前に何か指標が欲しいところです。。。
後、個人的には腎移植後にシャントがそのまま残っている人も多いので、閉鎖することも考えてみようと思いました。









